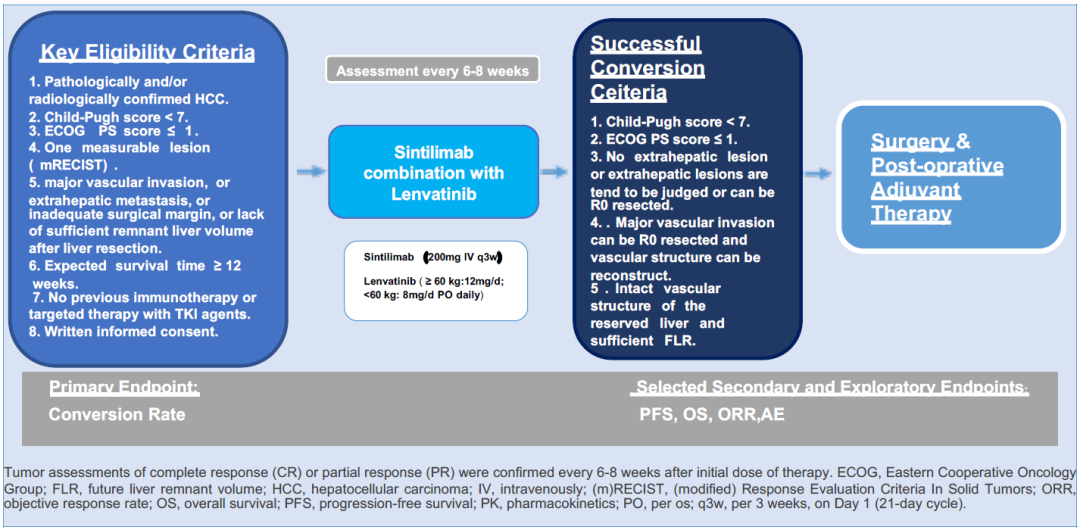
2022年9月8日,美国罗克维尔和中国苏州——信达生物制药集团(香港联交所股票代码:01801),一家致力于研发、生产和销售肿瘤、自免、代谢、眼科等重大疾病领域创新药物的生物制药公司,在2022年欧洲肿瘤内科学会年会(ESMO Congress 2022)以口头报告形式 (摘要编号LBA58) 公布达伯舒®(信迪利单抗注射液)联合或不联合达攸同®(贝伐珠单抗注射液)以及化疗用于表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗失败的EGFR突变非鳞状非小细胞肺癌(NSCLC)的随机、双盲、多中心3期临床研究(ORIENT-31,NCT03802240)第二次期中分析结果。 第二次期中分析结果显示,在意向治疗(ITT)人群中,基于独立影像评估委员会(IRRC)评估,达伯舒®(信迪利单抗注射液)+达攸同®(贝伐珠单抗类似物)联合化疗组(试验组A)、达伯舒®(信迪利单抗注射液)联合化疗组(试验组B)和化疗组(对照组C)的mPFS(95%CI)分别为7.2个月(6.6,9.3)、5.5个月(4.5, 6.1)和4.3个月(4.1, 5.3)。本次分析中,试验组A对比对照组C的PFS获益与第一次期中分析一致。试验组B对比对照组C获得了显著且具有临床意义的中位无进展生存期(mPFS)延长,风险比(HR)为0.723(95%CI: 0.552, 0.948, P=0.0181),达到预设的优效性标准。此外,试验组B对比对照组C在关键次要疗效终点客观缓解率(ORR)和缓解持续时间(DOR)上也均有提高。ORIENT-31研究是全球首个证实PD-1免疫抑制剂±贝伐珠单抗联合化疗相比当前标准治疗能够显著延长EGFR-TKI治疗失败的EGFR突变非鳞NSCLC人群PFS的前瞻性、双盲3期研究。安全性特征与既往报道的信迪利单抗、贝伐珠单抗相关临床研究结果一致,无新的安全性信号。 ORIENT-31研究的主要研究者、上海市胸科医院肿瘤科陆舜教授表示:“EGFR-TKI靶向治疗是EGFR敏感突变NSCLC患者的首选治疗方案,然而在使用TKI类药物治疗后,几乎所有的患者最终都会出现耐药而导致疾病进展,而耐药后的含铂化疗疗效并不理想,因此耐药的问题及耐药后的治疗选择成为临床医生主要关注的内容。近年来,免疫治疗在驱动基因阴性NSCLC患者中发展迅速,然而在驱动基因阳性的NSCLC患者上一直鲜有突破。ORIENT-31研究表明,与标准含铂化疗相比,信迪利单抗免疫治疗联合化疗在EGFR-TKI耐药后 NSCLC患者中存在PFS获益,证实了免疫治疗在该人群的作用价值,该联合治疗方案也有望成为EGFR-TKI耐药后NSCLC患者的治疗选择之一,为患者带来更多获益。” 信达生物制药集团高级副总裁周辉博士表示:“获得性耐药对于经过一、二、三代EGFR-TKI治疗的EGFR突变肺癌患者不可避免,后续治疗手段十分有限,存在巨大的未满足的临床需求。去年底ORIENT-31第一次期中分析结果显示信迪利单抗联合贝伐珠单抗以及化疗对比化疗获得了显著且具有临床意义的mPFS延长,提示对于EGFR TKI治疗失败的NSCLC,免疫治疗联合抗血管治疗以及化疗可以成为一个新的治疗选择。而在本次ESMO年会公布的ORIENT-31第二次期中分析,我们惊喜地发现免疫治疗联合化疗也同样可以在该人群中获益,提示了免疫联合治疗在延长这部分肺癌患者生存期上的临床价值和潜力,也期待这两种免疫联合方案能为EGFR-TKI耐药的NSCLC患者带来生存获益。” 关于EGFR突变非鳞状NSCLC 肺癌是全球死亡率最高的恶性肿瘤,其发病率位居全球恶性肿瘤发病率的第二位。在所有肺癌中非小细胞肺癌(NSCLC)大约占80%至85%,约70%的NSCLC患者在诊断时已是不适于手术切除的局部晚期或转移性疾病。中国NSCLC患者中约70%为非鳞状非小细胞肺癌,其中EGFR突变的非鳞状非小细胞肺癌患者大约占40%至50%,该类患者一线标准治疗推荐三代EGFR-TKI,或一、二代EGFR-TKI,但在EGFR-TKI治疗进展后的治疗选择及疗效仍十分有限,存在着巨大的未满足的临床需求。 关于ORIENT-31研究 ORIENT-31研究是一项比较达伯舒®(信迪利单抗注射液)联合或不联合达攸同®(贝伐珠单抗生物类似物)以及化疗用于经EGFR-TKI治疗进展的EGFR突变的局部晚期或转移性非鳞非小细胞肺癌患者的有效性和安全性的随机、双盲、多中心三期临床研究(ClinicalTrials.gov, NCT03802240)。主要研究终点为BIRRC根据RECIST v1.1标准评估的无进展生存期,次要研究终点包括总生存期(OS)、研究者根据RECIST v1.1标准评估的无进展生存(PFS)、客观缓解率(ORR)和安全性等。 研究允许入组的受试者包括:一、二代EGFR TKI治疗进展且T790M阴性受试者,一、二代EGFR TKI治疗进展后T790M阳性且接受三代EGFR TKI治疗进展受试者,以及一线接受三代TKI治疗进展受试者。受试者随机入组,分别接受达伯舒®+达攸同®+培美曲塞+顺铂(试验组A),或达伯舒®+安慰剂2+培美曲塞+顺铂(试验组B),或安慰剂1+安慰剂2+培美曲塞+顺铂(对照组C),联合治疗4周期后,分别继续接受达伯舒®+达攸同+培美曲塞、达伯舒®+安慰剂2+培美曲塞、安慰剂1+安慰剂2+培美曲塞维持治疗,直至疾病进展、毒性不可耐受或其他需要终止治疗的情况。共计划入组630例。至第二次期中分析数据截止日,共计入组476例患者。